marco the chemistry
2014-02-05 19:09
Prima di iniziare devo dire che la sintesi è stata presa dal blog di Al, che ringrazio ancora una volta!
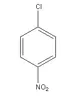
Il prodotto è un buon punto di partenza per la sintesi del ben più utile 2,4 dinitroclorobenzene (che spero di presentare tra un po' ed è indispensabile per avere l'isomero puro, non contaminato dal 2,6 dinitroclorobenzene che si forma durante la doppia nitrazione diretta con KNO3/H2SO4.
ed è indispensabile per avere l'isomero puro, non contaminato dal 2,6 dinitroclorobenzene che si forma durante la doppia nitrazione diretta con KNO3/H2SO4.
Materiali:
- clorobenzene ridistillato (bp 131°)
- acido nitrico 65%
- acido solforico 98%
- bagno di ghiaccio
- etanolo
Procedimento:
In un becker o una beuta da 500ml si pongono 100ml di HNO3 65% e 100ml di acido solforico 98%, la reazione è esotermica e si raffredda la miscela nitrante in bagno di acqua e ghiaccio fino a che la temperatura non scende a 15-20°. A questo punto si misurano 50ml di clorobenzene e li si aggiunge lentamente e sotto costante agitazione alla miscela nitrante. La temperatura non deve salire oltre i 30°C.
Terminata l'aggiunta (circa 30min) si agita ancora per un'oretta, dopodichè la fase superiore liquida solidifica in un solido giallino chiaro. Ho fatto riposare un'altra ora e poi ho versato in 300ml di acqua fredda, precipita subito il nitrocloro benzene come solido cristallino giallo chiaro.
Questo viene filtrato e lavato abbondantemente con acqua fredda.
Il grezzo è composto da una miscela di o- e p- isomeri, che vengono separati tramite cristallizzazione frazionata da metanolo o etanolo.
Si dissolve il solido ancora umido in circa 200ml di etanolo e si scalda ad ebollizone. Per raffreddamento si depone l'isomero para come cristalli aghiformi leggermente giallini, questi vengono filtrati su bukner, lavati con poco metanolo freddo e fatti asciugare all'aria.
Facendo evaporare le acque madri all'aperto si deposita una buona quantità di orto isomero però impuro del residuo di para isomero. (sta ancora evaporando...la temperatura non aiuta molto)
La resa in isomero para è stata di 40g, pari al 51% della teorica. Il composto ha un leggero odore di mandorla amara, tipo nitrobenzene, ma molto molto più lieve e meno fastidioso, ma non è cosa buona odorarlo troppo...
Devo trovare un modo di separare l'orto isomero (che tra l'altro può tornare utile dall'isomero para. Magari distillando in corrente di vapore, magari il p-nitroclorobenzene non è volatile...Se qualcuno ha idee, proponga!
Al nel suo esperimento non ha purificato l'isomero orto perchè ha lavorato con quantità 5 volte inferiori alle mie e non ne valeva la pena...ma con le quantità in gioco il prodotto non è trascurabile e mi spiace un po' cacciarlo via...
I seguenti utenti ringraziano marco the chemistry per questo messaggio: Max Fritz, al-ham-bic