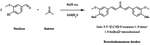Teor.Ema
2023-04-13 11:56
Ciao a tutti!
Oggi vi propongo una sintesi che probabilmente è vista e rivista, ma dato che l'ho fatta perchè no! Sono partito senza idee particolari, ma aprendo l'armadio degli organici e ho trovato in fondo delle bustine di vanillina alimentare, allora senza fare alcuna ricerca ho aperto il Cranwell (3a ed. pp. 460-462; libro di Organica sperimentale che ho amato alla follia e consiglio a tutti) cercando qualcosa da farci semplicemente per usare quelle rimanenze di acquisti fatti anni fa! La prima cosa che mi salta all'occhio è la classica condensazione Benzaldeide-Acetone, provo a fare i calcoli di proporzione tra benzaldeide e vanillina, la faccio, la soluzione si colora e non ottengo nessun precipitato... allora penso bene di scrivermi la reazione e disegnando mi ricordo di quanto infame possa essere l'ossidrile fenolico. Il loro prodotto precipitava, il mio in soluzione alcalina era solubile come il sale. 
Ho accantonato la sintesi per una qualche settimana, ma poi settimana scorsa mentre una reazione richiedeva di stare a reflusso 8h mi sono rimesso a "ciappinare" e sono arrivato ad una procedura carina. 
Reagenti, tutti Supermercato Grade:
- 3,80g di vanillina
- 0,75g di acetone
- 25mL di etanolo assoluto (unico analitico, ma penso vada bene il 96% anche se non ho verificato)
- 2,5g di NaOH
+Solventi per lavaggi del prodotto (Etanolo ed Et2O/DCM/EtOAC)
Procedura:
In un pallone da 50mL porre 25mL di etanolo assoluto e solubilizzare con l'aiuto di un ancoretta in agitazione magnetica la vanillina (3,8g; 25mmol; 2eq.), in un piccolo becher preparare una soluzione concentrata di NaOH (2,5g; eccesso) solubilizzando l'idrossido nella minima quantità di acqua, una volta che la soluzione è limida occorre lasciarla raffreddare completamente. In rapida agitazione aggiungere al pallone l'acetone (0,75g; 13mmol; 1.1eq), e porre il pallone in un cristallizzatore di acqua (10-20 gradi va più che bene) sempre sull'agitatore magnetico di modo che la temperatura sia più o meno costante. A questo punto aggiungere tutta la soluzione di NaOH velocemente e lasciare in agitazione per almeno 5-10 minuti. La reazione procede rapidamente e si osserva immediatamente un cambio di colore. Al termine dei 10 minuti filtrare su Buchner o Gosh (molto fine), lavare con 2x10mL EtOH e 2x10mL Et2O (in alternativa DCM o EtOAc). Il prodotto può essere ricristallizzato da Acqua-Etanolo. Il prodotto appare puro e può presentare piccole tracce di sodio vanillina eliminabili tramite ricristallizzazione o allungando leggermente il tempo di reazione.
IR (neat, ATR) 2900-2800 (C-H), 2711 singoletto(C-H metossi), 1653 (C=O coniugato), 1582 (C=C coniugato)
Spettro poco eloquente, evidentissima la presenza di un lungo sistema coniugato con spostamento di tutte le bande verso numeri d'onda più bassi.
Non ho fatto p.f. perchè sia su PubChem che su Reaxys non ci sono dati, l'IR sembra conforme e non ho modo di fare ne ESI ne NMR, quindi penso che le mie indagini al riguardo si concludano qui, ma è una dimostrazione molto carina che si può anche portare come laboratorio didattico. il prodotto è un bellissimo solido giallo pastello che si si comporta da indicatore acido base con viraggio a ph simili alla fenoftaleina e alla sua amica curcumina (proverò a farla quando avrò a disposizione l'acetilacetone). 
Attendo commenti, intanto grazie della lettura!
I seguenti utenti ringraziano Teor.Ema per questo messaggio: luigi_67, EdoB, Copper-65, ale93, ChemLore